Der Mukoviszidose e. V. unterstützt ein breites Spektrum an Forschungsprojekten, um langfristig eine Heilung der Mukoviszidose zu erreichen. Dieses reicht von der medizinischen Grundlagenforschung bis zu klinischen Studien.
Ziel der Forschungsförderung ist die Umsetzung neuer Erkenntnisse in neue und bessere Therapien und somit eine bessere Lebensqualität und Lebensverlängerung für Mukoviszidose-Betroffene.
Aktuell unterstützt der Mukoviszidose e.V. Landesverband Baden Württemberg folgende Studien mit Spendengeldern:
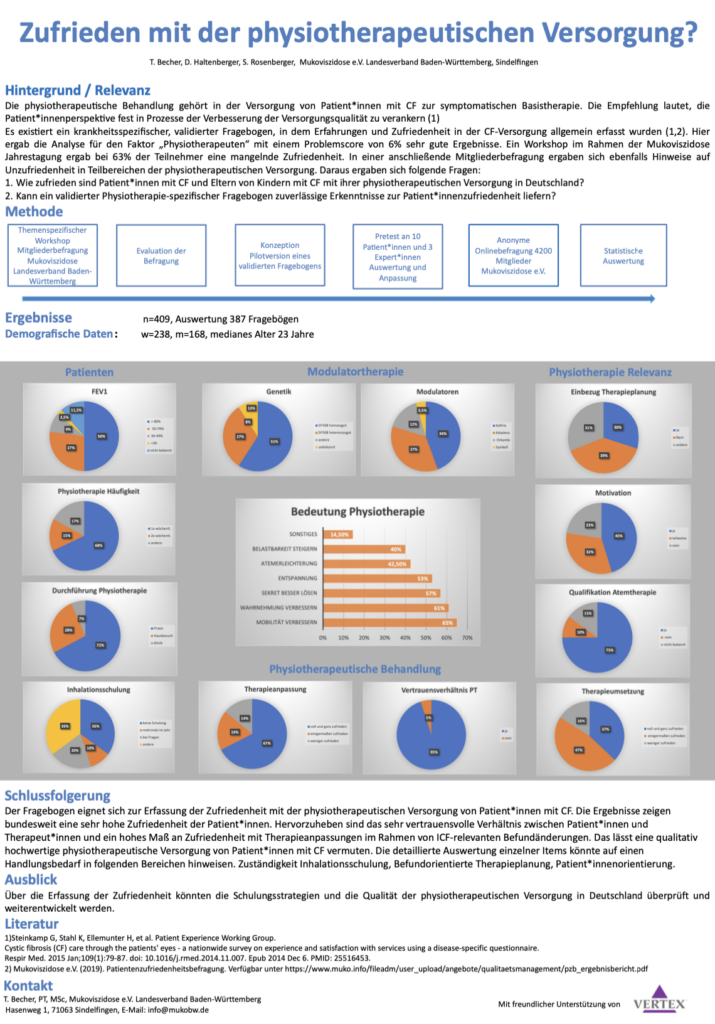
Studie / Umfrage zum Thema: Zufriedenheit mit der physiotherapeutischen Versorgung von Patientinnen und Patienten mit Cystischer Fibrose 2021
Autoren / Durchführende:
Thomas Becher, PT, MSc - Stuttgart
Daniela Haltenberger, PT, BSc - Dreieich
Finanzierung:
Gesponsert durch: Vertex Pharmaceuticals Germany GmbH
Abschlussbericht:
Der Abschlussbericht zur Umfrage / Studie kann -> hier heruntergeladen werden
Forschungsprojekt zu radiologischen und biochemischen Effekten bei Kindern, Jugendlichen und jungen Erwachsenen unter Supplementation mit dem Nahrungsergänzungsmittel CHOLIN auf die Cystische Fibrose-assoziierte Lebererkrankung
Antragstellerin:
Dr. Ute Graepler-Mainka, Universitätsklinik für Kinder- und Jugendmedizin, Abt. Allg. Pädiatrie, Hämatologie und Onkologie
Laufzeit:
24 Monate
Kosten:
€ 75.000,--
Finanzierung:
Der Landesverband Baden-Württemberg unterstützt das Projekt mit insgesamt € 60.000,-- (Eigenanteil der Klinik = € 10.000,--)
Kurzbeschreibung:
Primäres Ziel dieser prospektiven und randomisierten Studie ist die Beantwortung der Frage, ob Supplementierung von Mukoviszidosepatienten mit dem Nahrungsergänzungsmittel Cholin in Höhe der Menge, die dem Plasmaspiegel von Gesunden entspricht, auch Effekte auf die Leber-assoziierte Hepatopathie bei CF-Patienten auftreten. Hierfür werden laborchemische und bildgebende Kriterien beurteilt. Es findet keine Therapie mit dem Nahrungssupplement Cholin statt, sondern ausschließlich eine Beobachtung möglicher zusätzlicher Effekte auf eine bestehende Lebererkrankung in diesem Kollektiv, welche eine Supplementation bei erniedrigter Plasmakonzentration erhalten haben. Die Patienten werden nach Einverständnis zur Teilnahme in die Gruppe der Nahrungssupplementation bzw. in die Gruppe, welche Cellulose-Kapseln ohne Cholin einnimmt, randomisiert.
Das sekundäre Studienziel ist der Vergleich der bildgebenden Verfahren (MRT als Goldstandard gegenüber der Ultraschall-Untersuchung mit Elastographie und AT) in Bezug auf die Quantifizierung des Leberfettgehaltes und Leberparenchymveränderungen. Der Vergleich beider Untersuchungsmethoden ist hinsichtlich des primären Studienziels erforderlich, um die Austauschbarkeit der Methode zu prüfen und eine Steatosediagnostik ohne Sedierung durchführen zu können. Es ist ohne zusätzliche Belastung oder Risiken für die Studienteilnehmer möglich. Ziel ist es eine kostengünstige, schnelle und nicht belastende Untersuchungsmethode durch die Sonographie mit Elastographie für das Therapie-Monitoring der CF-assoziierten Lebererkrankung zu etablieren.
Forschungsprojekt zu Auswirkungen der Therapie mit Elexakaftor / Tezakaftor / Ivakaftor auf das Einzelzell-Transkriptom von nativen Atemwegsepithel- und Immunzellen bei CF-Patienten
Antragsteller:
Dr. med. Simon Gräber, Charité Universitätsmedizin, Abteilung für pädiatrische Beatmungsmedizn, Immunologie und Intensivmedizin, Berlin
Dr. rer. nat. Saskia Trump, Charité Universitätsmedizin, Molekulare Epidemologie, Berlin
Laufzeit:
24 Monate
Kosten:
€ 188.000,--
Finanzierung:
Der Landesverband Baden-Württemberg unterstützt das Projekt mit insgesamt € 94.000,--
Hintergund:
Die neue CFTR-Modulatortherapie mit Elexacaftor/Tezacaftor/Ivacaftor (ETI, Kaftrio) zeigt bei den meisten Betroffenen eine überzeugende Wirksamkeit, sowohl im klinischen Bild als auch in der Veränderung der Schweißchlorid-Werte. Es gibt allerdings sehr heterogene Therapieansprechen: Obwohl Personen die gleichen CFTR-Varianten tragen (z.B. F508del) zeigen sich unterschiedlich starke Effekt der Therapie. Die Ursache dafür wird auf zellulärer Eben vermutet, es ist aber noch nicht klar, was genau die Therapien auf zellulärer Ebene beim Einzelnen bewirken. Grundsätzlich bewirken CFTR-Modulatoren in der Zelle eine teilweise Wiederherstellung der Funktion des CFTR-Kanals.
Bei CF ist bekannt, dass die CFTR-Kanäle in den Atemwegszellen in ihrer Funktion eingeschränkt sind, wodurch die CF-typische Symptomatik mit festsitzendem Schleim entsteht. In den Atemwegen befinden sich verschiedene Zelltypen, jedoch nicht alle bilden gleichermaßen den CFTR-Kanal. Auch befinden sich dort Immunzellen, wie Monozyten und Neutrophile, von denen bei CF bekannt ist, dass sie in ihrer Funktion eingeschränkt bzw. verändert sein können, so dass Keime nicht effektiv bekämpft werden und Entzündungen entstehen können. Erste Erkenntnisse über die CFTR-Modulatortherapie zeigen, dass auch die Immunzellen durch die Therapie verändert werden könnten.
Was genau auf zellulärer Ebene passiert und wie die verschiedenen Zellen auf Modulatoren ansprechen, ist bislang nicht gut untersucht.
Um auf zellulärer Ebene zu verstehen, welche molekularen Vorgänge stattfinden, muss untersucht werden, welche Gene aktiv sind und exprimiert werden (Genexpression). Die Summe aller Gene, die abgelesen und in mRNA umgeschrieben (transkribiert) wird, wird unter Forschern als „Transkriptom“ bezeichnet. Aus dem Transkriptom können die Forscher ablesen, welche Gene von der Zelle tatsächlich verwendet werden und welche Genprodukte (z.B. CFTR-Kanäle, Zytokine) daraus entstehen sollen. Es gibt Auskunft über die Aktivität der Gene, allerdings nicht darüber, welche Proteine schlussendlich auch gebildet werden.
Eine Aussage über das Transkriptom einzelner Zellen oder Zelltypen ist noch gar nicht so lange möglich: erst durch die Methode von RNA-Einzelzell-Sequenzierung (scRNA-seq) kann aus einzelnen Zellen die jeweilige Genaktivität „abgelesen“ werden.
Ziele:
In dem Projekt sollen die Auswirkungen von Elexacaftor/Tezacaftor/Ivacaftor (Kaftrio) auf die Schleimhaut- und Immunzellen der Atemwege untersucht werden. Dabei wird die Aktivität aller Gene, das Transkriptom, einzelner Zellen bei verschiedene Patienten untersucht. Basierend darauf sollen Muster identifiziert werden, die mit starkem und schwachen Ansprechen auf die ETI-Therapie assoziiert sind. Aus diesen Erkenntnissen heraus sollen Biomarker identifiziert werden, die eine Voraussage zulassen, ob ein Patient auf die ETI-Therapie gut ansprechen wird oder nicht.
Methodik:
Arbeitspaket 1
Die Effekte der ETI-Therapie auf das Transkriptom werden durch RNA-EinzelzellSequenzierung (scRNA-seq) untersucht. Dazu werden bei 10 CF-Patienten mit mind. einer F508del-Mutation mithilfe eines Nasenabstrichs verschiedene Typen von Epithelzellen (Ionozyten, Basalzellen, Zilienzellen) und Immunzellen (Monozyten, Neutrophile) gewonnen. Die Proben werden vor, sowie drei Monate nach Beginn der ETI-Therapie genommen. Die Transkriptom-Analysen werden mit gesunden Kontrollpersonen verglichen, von denen bereits Proben vorliegen. Dabei soll sich zeigen, in welcher Form und in welchem Ausmaß die ETI-Therapie die Genexpression vergleichbar einem Gesunden wiederherstellt und ob bzw. welche abweichenden Genexpressions-Muster bestehen bleiben und durch mögliche neue Therapien adressiert werden müssen. Die Ergebnisse werden mit den klinischen Daten der Patienten korreliert.
Arbeitspaket 2
Dieselbe Technik (scRNA-seq) wird verwendet, um Unterschiede im Transkriptom bei 10 CFPatienten zu finden, die hinsichtlich der Schweißchloridwerte besonders gut bzw. besonders schlecht auf die ETI-Therapie ansprechen. Dadurch sollen Muster für ein gutes oder schlechtes Therapieansprechen verdeutlicht werden, die möglicherweise die Heterogenität des Therapieansprechens erklären können.
Arbeitspaket 3
Basierend auf den Ergebnissen der Arbeitspakete 1 und 2 sollen Biomarker identifiziert werden, mit denen das individuelle Therapieansprechen auf die ETI-Therapie voraussagbarer wird.
Ausblick:
Die Ergebnisse dieser Studie können neue Erkenntnisse über die molekularen Auswirkungen der pharmakologischen Wiederherstellung der CFTR-Funktion auf die oberen Atemwege liefern. Die Identifizierung von Mustern, die zu einem schwachen oder starken Ansprechen führen, sollen zu einem besseren Verständnis der zu Grunde liegenden Mechanismen eines schlechteren Ansprechens auf CFTR-Modulatoren führen. Diese Erkenntnisse können dazu beitragen, das Ansprechen auf eine CFTR-Modulatortherapie bei allen Patienten zu verbessern. Gelingt es, Biomarker für eine patientenindividuelle Vorhersage des klinischen Ansprechens zu finden und darüber auch neue therapeutische Ziele zu identifizieren, könnte die personalisierte Medizin für Menschen mit Mukoviszidose vorangebracht werden.
Forschungsprojekt zur Bakterien-Phagen-Interaktion
Antragsteller:
Prof. Dr. Martin Witzenrath - Charité Berlin
Start:
Mai 2022
Laufzeit:
12 Monate
Kosten:
€ 19.000,--
Überblick:
Das Projekt untersucht die Persistenz- und Resistenzmechanismen des Bakteriums Pseudomonas aeruginosa sowie seine Interaktion mit Phagen — und könnte künftig die Therapie chronischer Infektionen bei Mukoviszidose optimieren helfen. Resistenzen erschweren nachhaltige Bekämpfung von Pseudomonas-lnfektionen. Chronische Infektionen der Lunge mit Pseudomonas aeruginosa (PA) sind für viele Mukoviszidose-Patienten mit steigendem Alter ein Problem, da sie zu einer plötzlichen Verschlechterung der Lungenfunktion (Exazerbation) führen und die Lunge dadurch dauerhaft schädigen können. Die bei PA zunehmend auftretenden Resistenzen gegen die Therapie erschweren zudem eine nachhaltige Bekämpfung der Infektion. Die Mechanismen dieser Resistenzbildung genauer zu verstehen, hat sich die Arbeitsgrupppe um Prof. Dr. Martin Witzenrath und Dr. Gopinath Krishnamoorthy, an der Medizinischen Klinik mit Schwerpunkt Infektiologie und Pneumologie der Charité - Universitätsmedizin Berlin, mit dem aktuellen Forschungsprojektzur Aufgabe gemacht.
Biofilm und Alginathülle als Resistenzmechanismen.
Resistenzen gegenüber einer Therapie äußern sich bei Bakterien nicht allein dadurch, dass die Therapie die Bakterienzelle nicht effektiv abtöten kann, sondern auch darin, dass sich die Bakterien z.B. in einen Biofilm zurückziehen oder eine Hülle aus Alginat produzieren, welche die Therapie nicht durchdringen kann. Diese Mechanismen werden auch als Persistenz (weil die bakterielle Infektion trotz Therapie bestehen bleibt) oder Toleranz (weil die Bakterien die Therapie tolerieren, ohne abgetötet zu werden) bezeichnet.
Persistenz und Toleranz beziehen sich aber nicht auf Antibiotika-Therapien allein, auch gegen Bakteriophagen können sich Pseudomonaden auf diese Weise wehren, weil Phagen die mechanische Barriere aus Biofilm oder Alginathülle nicht überwinden können. Die molekularen Mechanismen, wie sich Persistenz bzw. Toleranz bei PA sind bisher nicht vollständig bekannt.
Untersuchung der Interaktion von Pseudomonaden und Bakteriophagen.
Diesen molekularen Mechanismus der bakteriellen Persistenz und seine Regulationsprinzipien zu identifizieren, ist das Ziel der Projektgruppe. Hierfür untersuchen die Wissenschaftler zum einen die Reaktion von PA auf die Infektion mit Bakteriophagen, und zwar u.a. mittels einer Messung der Genaktivität (TranskriptomAnalyse). Weiterhin wollen sie herausfinden, ob die Gabe sog. „Small Molecules" (wie ZB. L-cystein) dazu führt, die Mechanismen der Persistenz bzw. Toleranz von PA zu überwinden und die Therapie mit Antibiotika, aber auch mit Bakteriophagen zukünftig effektiver zu machen.
Weitere Informationen zur Arbeitsgruppe um Prof. Witzenrath: http://www.charite-inflab.de/witzenrath-lab/
Aspergillus-spezifisches IL-17A als neuer Biomarker der akuten allergischen bronchopulmonalen Aspergillose (ABPA) bei Mukoviszidose
Antragsteller:
Dr. med. Carsten Schwarz, Klinikum Westbrandenburg
Laufzeit:
24 Monate
Kosten:
109.000€
Hintergrund:
Die Lungenerkrankung der Mukoviszidose ist nicht nur durch bakterielle Infektionen geprägt, auch wenn diese meist im Vordergrund stehen. Die Lunge kann auch mit Pilzen besiedelt sein, deren Krankheitswert aber nicht immer klar ist. Der Fadenpilz Aspergillus fumigatus kommt bei ca. 25% der CF-Patienten vor und kann neben Lungenentzündungen auch Komplikationen wie die allergische bronchopulmonale Aspergillose (ABPA) verursachen. Aber nicht jede Besiedelung mit A. fumigatus bedeutet, dass der Patient auch eine ABPA hat, d. h. es stellt sich in der klinischen Praxis oft die Frage für den behandelnden Arzt, wann eine ABPA vorliegt. Die ABPA tritt bei bis zu 15 % der Patienten mit CF, aber zum Beispiel auch bei Patienten mit Asthma, auf. Insbesondere wenn eine ABPA spät diagnostiziert wird, können auch dauerhafte, irreversible Lungenschäden entstehen, die zum rascheren Fortschreiten der Lungenerkrankung führen.
Die Therapie der ABPA besteht zum einen aus antientzündlich wirksamen Corticosteroiden und zum anderen aus Substanzen, die gegen Aspergillus wirksam sind (Antimykotika). Um eine Behandlung vor dem Entstehen irreversibler Veränderungen einzuleiten, ist eine möglichst frühe Diagnosestellung essentiell. In frühen Krankheitsstadien sind die Symptome der ABPA jedoch noch unspezifisch (Verengung und vermehrte Schleimverlegung der Atemwege, Atemnot) und ähnlich denen, die durch bakterielle Krankheitserreger ausgelöst werden. Deshalb wird die ABPA noch häufig zu spät oder gar nicht diagnostiziert. Die Diagnosestellung der ABPA erfolgt anhand klinischer, radiologischer und laborchemischer Kriterien (entsprechend der 2003 von der CFF veröffentlichten internationalen Standards zur ABPA Diagnostik bei CF). Ausschlaggebend ist dabei eine starke Erhöhung allergietypischer und allergenspezifischer Antikörper (IgE). Anti-körper sind aber nach Antigen- oder Allergenkontakt für längere Zeit nachweisbar und spiegeln daher oft nicht die aktuelle immunologische Situation wider. Mit der kürzlich etablierten Methode der antigenreaktiven T-Zell-Anreicherung (ARTE) können pilzspezifische Immunreaktionen zeitgerechter charakterisiert werden und die ABPA Diagnostik bei CF möglicherweise verbessern. A. fumigatus löst in der Regel eine relativ geringe T-Zell Antwort aus, die bislang nicht detektierbar war – mit der ARTE Technologie werden die T-Zellen nun angereichert und sind nachweisbar – als spezifische Th1, Th2 und Th17-Zellen.
Ziele:
In einer Anfang 2019 publizierten Pilotstudie konnte die Arbeitsgruppe um Prof. Scheffold/Dr. Schwarz zeigen, dass A. fumigatus bei einer akuten und auch wiederkehrenden ABPA spezifische Th-17 Zellen anreichert. Unter einer ABPA Therapie verringerte sich diese Th-17 Immunantwort in dieser Untersuchung. Die Daten dieser Pilotstudie deuten damit darauf hin, die ARTE-Technologie für eine bessere ABPA-Diagnostik und Therapiekontrolle nutzen zu können. Die Th-17 spezifische Immunantwort bei ABPA soll demnach in dem beantragten Projekt jetzt an einer größeren Patientenkohorte mit CF und ABPA mithilfe der ARTE-Technik überprüft werden. Dabei sollen Grenzwerte ermittelt werden, um festlegen zu können, wann eine akute ABPA vorliegt. Dazu werden Patienten mit akuter pulmonaler Verschlechterung (Exazerbation) und ABPA mit einer Kontrollgruppe von Patienten mit Exazerbation ohne ABPA, deren Immunsystem aber bereits mit A. fumigatus in Kontakt gekommen ist (sensibilisiert hinsichtlich A. fumigatus), verglichen. Außerdem soll bei Patienten mit ABPA die Aspergillus fumigatus-spezifische Immunantwort in Form von IL-17A (ausgeschüttet von Th17-Zellen) untersucht werden, von der ange-nommen wird, dass sie während der gezielten ABPA-Therapie absinkt. Dadurch könnte IL-17A als Marker für den Therapieerfolg verwendet werden. Da IL-17A möglicherweise bei Patienten mit erhöhtem Risiko für eine ABPA andere Werte aufweist als bei Patienten, die keine ABPA entwickeln, soll IL-17A auch als prädiktiver Faktor bei Patienten vor dem Auftreten einer ABPA gemessen werden.
Methodik:
Das Projekt wird in Form einer prospektiven, nicht-randomisierten, kontrollierten offenen Kohortenstudie über 18 Monate durchgeführt. Es werden 1.400-1.600 Patienten aus den beteiligten 11 CF-Zentren gescreent, von denen 59 CF-Patienten mit akuter ABPA (nach derzeit gültigem internationalen Standard diagnostiziert) und 59 CF-Patienten ohne ABPA eingeschlossen werden sollen.
Die Patienten geben am Tag des Studienbeginns Blut- und Sputum-Proben ab, sowie zu dem Zeitpunkt, wenn sie eine Exazerbation durchmachen und 28 Tage danach. Außerdem werden sie klinisch untersucht und die Lungenfunktion gemessen, bei Exazerbationen werden auch bildgebende Verfahren eingesetzt. Das jeweilige CF-Zentrum entscheidet über eine notwendige Therapie, wenn eine ABPA auftritt. Sputumproben werden auf das Vorkommen von Pilzen untersucht, sowie Blutproben auf Antikörper (IgE). Weitere Blutproben werden von den CF-Zentren direkt nach Kiel verschickt und dort immunologisch, u.a. mit dem ARTE-Verfahren untersucht.
Ausblick:
Durch eine sensitivere ABPA-Diagnostik, die in dem Projekt untersucht werden soll, könnte eine ABPA früher diagnostiziert werden. Dadurch könnten irreversible Schäden an der Lunge verhindert und die Symptomlast bei den Patienten reduziert werden. Zudem könnten unnötige Anti-biotikatherapien, die aufgrund der anfangs noch unspezifischen Symptome häufig begonnen werden, vermieden werden. Durch Messung von IL-17A könnte außerdem die Wirksamkeit der ABPA-Therapie überwacht und das Risiko für das Auftreten einer ABPA besser abgeschätzt werden.
Darüber hinaus ist für die Zukunft vorstellbar, dass die ABPA mittels einer medikamentösen Blockade der Th17-Immunantwort behandelt werden könnte. Eine solche Therapie könnte im Vergleich zu Corticosteroiden eine bessere Verträglichkeit aufweisen.
Finanzierung:
Der Landesverband Baden-Württemberg unterstützt die Studie mit insgesamt 109.000 €
Identifikation von extrazellulären Antigenen als Virulenzfaktoren von
Pseudomonas aeruginosa unter anaeroben Bedingungen
Leitung der Studie:
Frau Dr. Sandra Schwarz, Institut für medizinische Mikrobiologie und Hygiene, Universität Tübingen
Beteiligten Wissenschaftler:
Annika Schmidt, Institut für medizinische Mikrobiologie und Hygiene, Universität Tübingen.
Professor Doktor Boris Macek, Proteomzentrum Tübingen
Laufzeit:
12 Monate
Ziel des Projekts:
Es sollen alternative Therapieansätze zur Behandlung der Pseudomonas-Infektion gefunden werden, die auf bisher nicht erforschten Proteinen basieren, die von Pseudomonas Aeruginosa unter anaeroben Bedingungen ausgeschüttet werden und als sogenannte „Virulenzfaktoren“ krankmachende Eigenschaften besitzen Bakterien sind extrem anpassungsfähig an Änderungen Ihre Lebensbedingungen. Entsprechend verändern sich auch die Pseudomonaden in der Lunge von CF Patienten, in dem sie sich zum Beispiel in weniger belüfteten Lungenarealen an die Lebensbedingungen ohne Sauerstoff (anaerob) anpassen. Im Laufe der Besiedelung und abhängig von den Lebensbedingungen entstehen bakterielle Nachkommen, die sich von dem ursprünglichen Bakterium, welches die Lunge zuerst besiedelt hat, unterscheiden. Die Forscher des Projekts sind nun besonders an den Pseudomonas Subpopulationen interessiert, die unter anaeroben Bedingungen in der Lunge von CF-Patienten leben. Sie vermuten, dass diese Bakterien andere krankmachende Faktoren in ihre Umgebung abgeben, als ihre unter Sauerstoffzufuhr lebenden Vorfahren. Bislang sind solche krankmachenden Exoproteine nicht systematisch für Pseudomonas Aeruginosa bei CF-Patienten untersucht worden. Das Ziel des Projektes ist, Pseudomonas Exoproteine zu finden, die unter anaeroben Bedingungen entstehen. Die Hypothese ist, dass diese anaeroben Exoproteine bisher noch nicht bekannte Faktoren sind, auf die zum einen das Immunsystem reagiert und die andererseits auch dafür sorgen, dass die Pseudomonaden Erkrankungssymptome verursachen. Es sollen besonders die Exoproteine gefunden werden, die in der frühen Phase der Infektion gebildet werden.
Methodik:
Blutseren von ca. 50 CF-Patienten mit chronischer Pseudomonas-Infektion sollen verwendet werden, um über die im Blut vorhandenen Antikörper der Patienten die Exoproteine heraus zu fischen, die für das Immunsystem relevant und daher immunogenen sind. Die dadurch gefundenen Exoproteine werden mit biochemischen Methoden charakterisiert. Die drei Exoproteine, die am häufigsten über die Antikörper in den Patienten-Seren identifiziert werden, sollen anschließend im Labor hergestellt werden und hinsichtlich der immunogenen Wirkung in weiteren Tests mit Blutseren von weiteren, anderen 50-100 CF-Patienten untersucht werden. Bestätigt sich, dass diese Exoproteine durch Antikörper gebunden werden, so ist davon auszugehen, dass diese Exoproteine tatsächlich eine immunogene Wirkung haben. Zusätzliche Untersuchungen zur Virulenz und Immunogenität der synthetisierten Exoproteine sind an Kaninchen und an Lungenepithel-Zellkulturen geplant.
Finanzierung:
Der Landesverband Baden-Württemberg unterstützt die Studie mit insgesamt rund 20.000 €
Abschlussbericht:
Der Abschlussbericht steht hier zum Download zur Verfügung