Der Mukoviszidose e. V. unterstützt ein breites Spektrum an Forschungsprojekten, um langfristig eine Heilung der Mukoviszidose zu erreichen. Dieses reicht von der medizinischen Grundlagenforschung bis zu klinischen Studien.
Ziel der Forschungsförderung ist die Umsetzung neuer Erkenntnisse in neue und bessere Therapien und somit eine bessere Lebensqualität und Lebensverlängerung für Mukoviszidose-Betroffene.
Aktuell unterstützt der Mukoviszidose e.V. Landesverband Baden Württemberg folgende Studien mit Spendengeldern:
Laufendes Projekt
Aufklärung von Entwicklungsdefekten der Mukoviszidose in der Bauchspeicheldrüse mithilfe eines innovativen Modells der menschlichen pluripotenten Stammzellerkrankung
Unraveling Developmental Defects of Cystic Fibrosis in the Pancreas using an innovative Human Pluripotent Stem Cell Disease Model
Projektleiter:
Jun.-Prof. Dr. Markus Breunig, Universitätsklinikum Ulm
Beteiligte Wissenschaftler:
Prof. Dr. Alexander Kleger, Universitätsklinikum Ulm
Laufzeit:
36 Monate (Start Dezember 2024)
Fördervolumen:
149.495,00 €
Hintergrund:
Neben der Lunge ist bei den meisten Mukoviszidose-Patienten auch die Bauchspeicheldrüse (Pankreas) von der Erkrankung betroffen – viele von ihnen haben Verdauungsprobleme und einen CF-assoziierten Diabetes. Wie genau diese Mukoviszidose-typische Pankreas-Symptomatik entsteht und welche Rolle das CFTR-Protein dabei spielt, ist noch nicht bekannt. Mit Hilfe eines Pankreas-Organoid-Modells erforscht die Arbeitsgruppe um Jun.-Prof. Dr. rer. nat. Markus Breunig (Universitätsklinikum Ulm) nun die molekularen Mechanismen der Krankheitsentstehung. Rund 80% der Menschen mit Mukoviszidose haben eine reduzierte Funktionstüchtigkeit der Bauchspeicheldrüse (Pankreasinsuffizienz) und dadurch zu wenig oder keine Verdauungsenzyme. Folgen sind gastrointestinale Probleme wie Bauchschmerzen, Durchfälle, Gewichtsverlust und Nährstoffmangel. Die Pankreasinsuffizienz erfordert eine lebenslange Einnahme von Enzympräparaten zu den Mahlzeiten. Neben dieser exokrinen Fehlfunktion der Bauchspeicheldrüse entwickeln rund die Hälfte aller Mukoviszidose-Betroffenen mit steigendem Lebensalter auch einen CF-assoziierten Diabetes mellitus (engl.: Cystic fibrosis related diabetes – CFRD), der meist mit Insulingaben behandelt werden muss. Um neue, Mukoviszidose-spezifische Therapieansätze für diese Symptome entwickeln zu können, braucht es ein besseres Verständnis der Krankheitsentstehung und auch der Rolle des CFTR-Proteins in den verschiedenen Zellen des Pankreas.
Ziele und Methodik:
Die Arbeitsgruppe um Markus Breunig hat unter Verwendung von humanen pluripotenten Stammzellen ein Pankreas-Organoid-Modell im Labor etabliert, mit welchem die zeitliche und zelluläre Abfolge der Entstehung von Mukoviszidose in der Bauchspeicheldrüse untersucht werden kann. Die Wissenschaftler verfolgen die Hypothese, dass frühe Veränderungen in der embryonalen Entwicklung maßgeblichen Anteil an einer späteren Symptomatik (Verdauungsprobleme, Diabetes) haben. Bereits bekannt ist, welche Zellen im Pankreas den CFTR-Kanal bilden, allerdings wurde der genaue Prozess der CFTR-Bildung in diesem Organ bisher nur unvollständig am Menschen erforscht. Um ein besseres Verständnis der molekularen Mechanismen dieses Prozesses zu bekommen, bilden die Wissenschaftler zunächst im Organoid-Modell die wichtigsten Zelltypen der Bauchspeicheldrüse ausgehend von humanen pluripotenten Stammzellen aus und untersuchen, wo und wann diese CFTR produzieren. Die Zellen werden anschließend in exokrine Zellen (produzieren Verdauungsenzyme) und endokrine Zellen (produzieren Blutzucker-regulierende Hormone wie Insulin und Glucagon) differenziert und mit „gesunden Kontrollzellen“ verglichen.
Ausblick:
Die systematische Analyse der verschiedenen Zelltypen im Organoid-Modell soll zeigen, welche Rolle das CFTR-Protein in den verschiedenen Zellen des Pankreas für die Zellentwicklung und Zellfunktionalität spielt. Um die Möglichkeiten einer frühen therapeutischen Behandlung zu untersuchen, sind darüber hinaus Experimente geplant, in denen Entwicklung und Funktionalität der Zellen in unterschiedlichen Stadien mit und ohne CFTR-Modulator verglichen werden. So kann herausgefunden werden, ob eine frühzeitige Verabreichung von Modulatoren CF-typische Veränderungen der Pankreaszellen verhindern kann.
Laufendes Projekt
Anwendung von Atemwegskommensalen und deren Metaboliten zur Steigerung der therapeutischen Effizienz von CFTR-Modulatoren
Application of airway commensals and their metabolites to increase therapeutic efficiency of CFTR modulators
Projektleiter:
Dr. Andrew Tony-Odigie, Universitätsklinikum Heidelberg
Beteiligte Wissenschaftler:
Prof. Dr. Alexander Dalpke, Dr. Olaf Sommerburg, Universitätsklinikum Heidelberg, Prof. Dr. Marcus Mall, Charité-Universitätsmedizin Berlin
Laufzeit:
24 Monate (Start Oktober 2024)
Fördervolumen:
148.330 €
Hintergrund:
Die chronische Infektion der Lunge mit pathogenen (krankmachenden) Keimen ist nach wie vor ein ungelöstes Problem bei Menschen mit Mukoviszidose, auch unter erfolgreicher ETI-Therapie (Dreifachkombination Elexacaftor/Tezacaftor/Ivacaftor). So kann z.B. die häufig vorkommende Besiedelung mit Pseudomonas aeruginosa (PA) zu einer plötzlichen Verschlechterung der Lungenfunktion (Exazerbation) führen, die den gesamten Gesundheitszustand des Patienten belastet. Ein vielversprechender Ansatz für neue Therapieoptionen liegt in der Erforschung der wechselseitigen Beeinflussung von pathogenen und kommensalen Keimen im Lungenmikrobiom.
Ziele:
In Vorarbeiten konnte die Arbeitsgruppe um Dr. Andrew Tony-Odigie zeigen, dass bestimmtekurzkettige Fettsäuren (small chain fatty acids, kurz SCFA), die als Stoffwechselprodukte von einigen kommensalen Streptococcus-Arten freigesetzt werden, einen hemmenden Effekt auf Pseudomonas aeruginosa haben und dabei auch die durch PA verursachte Entzündungsreaktion im Gewebe abmildern. Darauf aufbauend untersuchen die Wissenschaftler im aktuellen Projekt, inwieweit sich eine CFTR-Modulatortherapie auf das Zusammenspiel der verschiedenen Bakterien in der Lunge auswirkt und ob es bislang nicht bekannte Interaktionen zwischen ETI- Therapie und den kommensalen Bakterien gibt, die zu einer - evtl. gegenseitigen - Wirkverstärkung führen. Am konkreten Beispiel der zuvor identifizierten kommensalen Streptococcus-Arten und der von diesen freigesetzten kurzkettigen Fettsäuren sollen die möglichen synergistischen Wechselwirkungen im Versuch überprüft werden.
Methodik:
Die Untersuchung der Fragestellung an Nasenepithelzellen von Menschen mit Mukoviszidose (mit mindestens einer Kopie der F508del-Mutation) wird in drei Arbeitspaketen durchgeführt: Im ersten Schritt wird in einem probiotischen CFTR-Modulator-Ansatz die Interaktion von kommensalen Bakterien und CFTR-Modulatoren analysiert. Im folgenden Arbeitspaket wird in einem postbiotischen CFTR Modulator-Ansatz die Wechselwirkung von kurzkettigen Fettsäuren und CFTR-Modulatoren untersucht. Ein weiteres Arbeitspaket weitet die Untersuchung aus auf die Interaktion von kommensalen Bakterien/deren Stoffwechselprodukten und CFTR-Modulatoren bei anderen, derzeit nicht behandelbaren CFTR-Mutationen. Ziel ist es, zu beobachten, ob die synergistischen Wechselwirkungen, falls vorhanden, auf die CFTR-Mutationen ausgedehnt werden können, die noch nicht mit Modulatoren behandelt werden können.
Ausblick:
Wenn sich die Hypothese der Wissenschaftler bestätigt und es synergistische Wechselwirkungen zwischen CFTR-Modulatoren und Kommensalen gibt, liegt hierin ein großes Potenzial für Patienten mit Mukoviszidose, das die Therapie bei chronischen Lungeninfektionen künftig entscheidend verbessern könnte.
Laufendes Projekt
Entwicklung einer tRNA-basierten genetischen Therapie zur Behandlung von Stopp-Mutationen
Projektleitung:
Dr. rer. nat. Suki Albers-Fomenko; Universität Hamburg, Institut für Biochemie und molekularer Biologie
Beteiligte Wissenschaftler:
Prof. Dr. Zoya Ignatova; Universität Hamburg; Universität Hamburg, Institut für Biochemie und molekularer Biologie
Prof. Dr. Marcus Mall; Klinik für Pädiatrie mit Schwerpunkt Pneumologie und Immunologie der Charité Berlin
Dr. Anita Balázs; Klinik für Pädiatrie mit Schwerpunkt Pneumologie und Immunologie der Charité Berlin
Laufzeit:
24 Monate (Start 2025)
Fördervolumen:
€ 185.540,--
Finanzierung:
Der Landesverband Baden-Württemberg unterstützt das Projekt vollständig
Einleitung:
Während die CF-Modulatoren für ca. 85 % der CF-Patienten in Frage kommen, gibt es für eine große Gruppe von CF-Patienten mit Stopp-Mutationen bisher keine Behandlungsmöglichkeit. Stopp-Mutationen unterbrechen die Synthese während der Herstellung von Proteinen. Je nachdem wo das falsche Stopp-Signal im Gen vorkommt, geschieht das früh oder erst gegen Ende der Herstellung des Proteins. Fehlerhafte Stopp-Signale führen zu einem verkürzten CFTR-Protein, welches die Zelle in der Regel nicht verwenden kann, daher abgebaut wird und der Zelle fehlt. Das Ziel dieses Projektes ist es, therapeutisch nutzbare tRNAs1 (Suppressor-tRNA = Sup-tRNA) zu entwickeln, die während der Bildung des CFTR-Proteins an fehlerhafte Stoppsignale binden und die Proteinkette fortsetzen – es also nicht zum Abbruch kommt, sondern der passende oder ein ähnlicher Proteinbaustein eingesetzt wird und die Synthese fortgesetzt werden kann. In vorherigen Arbeiten hatte die Arbeitsgruppe bereits gezeigt, dass Sup-tRNAs im Labor hergestellt werden können, die fehlerhafte Stopp-Signale „überlesen“, d. h. sie erkennen fehlerhafte Stopp-Signale, binden daran und bauen an der Stelle sogar die benötigte Aminosäure ein. Die Machbarkeit des Ansatzes wurde damit gezeigt und auch sehr gut publiziert, der Adolf-Windorfer-Preis wurde 2024 an Frau Albers-Fomenko für die Publikation „Engineered tRNAs suppress nonsense mutations in cells and in vivo“ in der renommierten Fachzeitschrift Nature verliehen (Albers, S., Allen, E.C., Bharti, N. et al. Engineered tRNAs suppress nonsense mutations in cells and in vivo. Nature 618, 842–848 (2023). https://doi.org/10.1038/s41586-023-06133-1). Diese Arbeit wurde zu einem großen Teil durch eine frühere Projektförderung des Mukoviszidose e. V. ermöglicht („RNA-basierte Methode zur zielgerichteten Korrektur von CFTR-Nonsense-Mutationen“; Projektnummer 2105).
Das nun geplante Projekt ist demnach die konsequente Fortsetzung der Förderung und es sollen systematisch für möglichst viele Stopp-Mutationen im CFTR-Gen wirksame Sup-tRNAs entwickelt werden, die eine Herstellung eines funktionalen CFTR-Proteins ermöglichen. Für den Nachweis der Wiederherstellung der CFTR-Funktion durch Sup- tRNAs sollen u. a. Experimente im Labor an Zellen der Nasenschleimhaut durchgeführt werden, die von Menschen mit verschiedenen CFTR-Stopp-Mutationen stammen. Dabei soll nicht nur auf die CFTR-Funktion geschaut werden, auch die Auswirkung auf den Schleim, , den die Zellen nach der Behandlung mit Suppressor-tRNAs produzieren, wird untersucht. Die Arbeit wird in Kooperation mit der AG Mall an der Charité in Berlin durchgeführt. Dabei ist im ersten Jahr der Projektdurchführung die Herstellung verschiedener Sup-tRNAs und deren Untersuchung in der Hamburger Arbeitsgruppe anhand von etablierten Labormodellen geplant (in-vitro).
Vielversprechende Sup-tRNAs werden dann im zweiten Jahr der Laufzeit in der Berliner Arbeitsgruppe hinsichtlich der Wirksamkeit an Epithelzellen von Menschen mit Stoppmutationen untersucht (ex vivo). Zur Realisierung des Projekts bietet die Kooperation der beiden Arbeitsgruppen ein multi-disziplinäres Team mit Molekularbiologen, Biochemikern, Medizinern und medizinischen Naturwissenschaftlern und möchte mit dem Projekt die präklinischen Daten generieren, die für eine klinische Weiterentwicklung von Sup-tRNAs als molekulare Therapie für CF-Patienten mit Nonsense Mutationen notwendig sind.
Ziele:
Das Ziel des Projektes ist es, für möglichst viele Menschen mit Stopp Mutationen im CFTR-Gen wirksame Suppressor-tRNAs zu entwickeln. Dies soll erreicht werden durch:
(1) die Erweiterung des Repertoires an Sup-tRNAs für möglichst viele Stopp-Mutationen
(2) die Untersuchung der Wirksamkeit der Sup-tRNAs unter Einbeziehung des therapeutischen Schwellenwerts hinsichtlich CFTR-Aktivität
(3) die Bestimmung einer geeigneten Sup-tRNA Dosis und die Evaluierung der Sicherheit der Sup-tRNAs
(4) die Untersuchung der Eignung von Sup-tRNAs für den sogenannten „Basket Approach“ (das Zusammenfassen von verschiedenen Stopp-Mutationen entsprechend des Proteinbausteins, der anstelle des Stopp-Signals eingebaut werden soll/kann oder auch die Zusammenstellung eines Cocktails aus verschiedenen Sup-tRNAs. Dadurch ist die Entwicklung eines Sup-tRNA-Präparats für verschiedene CFTR Stopp-Mutationen denkbar).
Methodik:
Für das Projekt werden verschiedene molekular-biologische und physiologische Methoden verwendet. Das Screening der Sup-tRNAs (d. h. die Entwicklung und Identifikation von geeigneten Sup-tRNAs) erfolgt in der Arbeitsgruppe in Berlin an etablierten Zellmodellen. Nach der Identifikation von vielversprechenden Sup-tRNAs wird die Herstellung, Lokalisation in der Zelle und die Funktionalität des CFTR-Proteins in Epithelzellen (isoliert aus Nasal-Bürstungen von CF-Patienten) mit den entsprechenden Stopp-Mutationen getestet. Die molekulare Sicherheit und die Off-Target-Effekte2 der Sup-tRNAs bzw. Sup-tRNA Cocktails werden ebenfalls an Zellen und Geweben von Menschen mit CFTR-Stoppmutationen untersucht.
Ausblick:
Für Menschen mit Stopp-Mutationen im CFTR-Gen, ca. 13% in Europa, gibt es bisher keine zugelassenen Behandlungsmöglichkeiten. Von der Entwicklung eines Sup-tRNA-basierten Therapieansatzes würde daher eine große Gruppe an CF-Betroffenen profitieren, viele davon ohne kausale Therapieoption derzeit (denn Modulatoren wirken am CFTR-Protein, bei frühem Abbruch der Herstellung durch Stopp Mutationen fehlt in der Zelle das CFTR-Protein und damit die Wirkstelle für Modulatoren). Das Design von Sup-tRNAs mit verschiedenen Proteinbausteinen (Aminosäuren) bietet einen Therapieansatz für verschiedene CFTR-Stoppmutationen innerhalb des CFTR-Gens (d.h. Sup-tRNAs sollen so entwickelt werden, dass sie bei verschiedenen Stopp-Mutationen eingesetzt werden können, je nachdem welcher Baustein benötigt wird). Auch ein Cocktail von verschiedenen Sup-tRNAs als therapeutisches Präparat wäre denkbar. Die Arbeitsgruppe beabsichtigt jedenfalls die Sup-tRNAs so zu gestalten, dass für die klinische Forschung Präparate zur Verfügung stehen sollen, die gleich mehrere Stopp-Mutationen abdecken können (Basket-Approach). Dadurch soll die Anzahl an klinischen Zulassungen reduziert werden und Studien an einer größeren Gruppe möglich werden (Studien für einzelne Stopp-Mutationen sollen dadurch vermieden werden), was für die Machbarkeit der klinischen Testung sehr relevant sein wird.
Laufendes Projekt
Forschungsprojekt zu radiologischen und biochemischen Effekten bei Kindern, Jugendlichen und jungen Erwachsenen unter Supplementation mit dem Nahrungsergänzungsmittel CHOLIN auf die Cystische Fibrose-assoziierte Lebererkrankung
Antragstellerin:
Dr. Ute Graepler-Mainka, Universitätsklinik für Kinder- und Jugendmedizin, Abt. Allg. Pädiatrie, Hämatologie und Onkologie
Laufzeit:
24 Monate
Kosten:
€ 75.000,--
Finanzierung:
Der Landesverband Baden-Württemberg unterstützt das Projekt mit insgesamt € 60.000,-- (Eigenanteil der Klinik = € 10.000,--)
Kurzbeschreibung:
Primäres Ziel dieser prospektiven und randomisierten Studie ist die Beantwortung der Frage, ob Supplementierung von Mukoviszidosepatienten mit dem Nahrungsergänzungsmittel Cholin in Höhe der Menge, die dem Plasmaspiegel von Gesunden entspricht, auch Effekte auf die Leber-assoziierte Hepatopathie bei CF-Patienten auftreten. Hierfür werden laborchemische und bildgebende Kriterien beurteilt. Es findet keine Therapie mit dem Nahrungssupplement Cholin statt, sondern ausschließlich eine Beobachtung möglicher zusätzlicher Effekte auf eine bestehende Lebererkrankung in diesem Kollektiv, welche eine Supplementation bei erniedrigter Plasmakonzentration erhalten haben. Die Patienten werden nach Einverständnis zur Teilnahme in die Gruppe der Nahrungssupplementation bzw. in die Gruppe, welche Cellulose-Kapseln ohne Cholin einnimmt, randomisiert.
Das sekundäre Studienziel ist der Vergleich der bildgebenden Verfahren (MRT als Goldstandard gegenüber der Ultraschall-Untersuchung mit Elastographie und AT) in Bezug auf die Quantifizierung des Leberfettgehaltes und Leberparenchymveränderungen. Der Vergleich beider Untersuchungsmethoden ist hinsichtlich des primären Studienziels erforderlich, um die Austauschbarkeit der Methode zu prüfen und eine Steatosediagnostik ohne Sedierung durchführen zu können. Es ist ohne zusätzliche Belastung oder Risiken für die Studienteilnehmer möglich. Ziel ist es eine kostengünstige, schnelle und nicht belastende Untersuchungsmethode durch die Sonographie mit Elastographie für das Therapie-Monitoring der CF-assoziierten Lebererkrankung zu etablieren.
Abgeschlossenes Projekt
Forschungsprojekt zu Auswirkungen der Therapie mit Elexakaftor / Tezakaftor / Ivakaftor auf das Einzelzell-Transkriptom von nativen Atemwegsepithel- und Immunzellen bei CF-Patienten
Antragsteller:
Dr. med. Simon Gräber, Charité Universitätsmedizin, Abteilung für pädiatrische Beatmungsmedizn, Immunologie und Intensivmedizin, Berlin
Dr. rer. nat. Saskia Trump, Charité Universitätsmedizin, Molekulare Epidemologie, Berlin
Laufzeit:
24 Monate
Kosten:
€ 188.000,--
Finanzierung:
Der Landesverband Baden-Württemberg unterstützte das Projekt mit insgesamt € 94.000,--
Überblick:
In dem Projekt wurden die Auswirkungen von Elexacaftor/Tezacaftor/Ivacaftor (Kaftrio) auf die Schleimhaut- und Immunzellen der Atemwege untersucht. Dabei wurde die Aktivität aller Gene, das Transkriptom, einzelner Zellen bei verschiedene Patienten untersucht. Basierend darauf sollten Muster identifiziert werden, die mit starkem und schwachen Ansprechen auf die ETI-Therapie assoziiert sind. Aus diesen Erkenntnissen heraus sollten Biomarker identifiziert werden, die eine Voraussage zulassen, ob ein Patient auf die ETI-Therapie gut ansprechen wird oder nicht.
Abschlussbericht:
Der Abschlussbericht zur Studie kann -> hier heruntergeladen werden
Abgeschlossenes Projekt
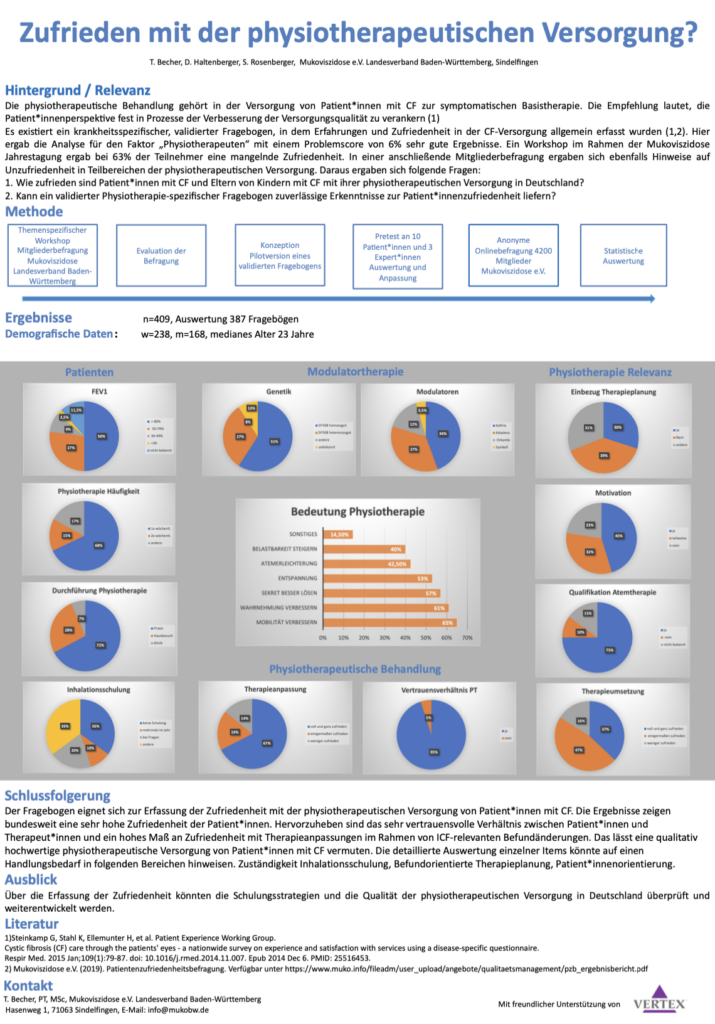
Studie / Umfrage zum Thema: Zufriedenheit mit der physiotherapeutischen Versorgung von Patientinnen und Patienten mit Cystischer Fibrose 2021
Autoren / Durchführende:
Thomas Becher, PT, MSc - Stuttgart
Daniela Haltenberger, PT, BSc - Dreieich
Finanzierung:
Gesponsert durch: Vertex Pharmaceuticals Germany GmbH
Abschlussbericht:
Der Abschlussbericht zur Umfrage / Studie kann -> hier heruntergeladen werden
Abgeschlossenes Projekt
Forschungsprojekt zur Bakterien-Phagen-Interaktion
Antragsteller:
Prof. Dr. Martin Witzenrath - Charité Berlin
Start:
Mai 2022
Laufzeit:
12 Monate
Finanzierung:
€ 19.000,--
Überblick:
Das Projekt untersuchte die Persistenz- und Resistenzmechanismen des Bakteriums Pseudomonas aeruginosa sowie seine Interaktion mit Phagen — und könnte künftig die Therapie chronischer Infektionen bei Mukoviszidose optimieren helfen. Resistenzen erschweren nachhaltige Bekämpfung von Pseudomonas-lnfektionen. Chronische Infektionen der Lunge mit Pseudomonas aeruginosa (PA) sind für viele Mukoviszidose-Patienten mit steigendem Alter ein Problem, da sie zu einer plötzlichen Verschlechterung der Lungenfunktion (Exazerbation) führen und die Lunge dadurch dauerhaft schädigen können. Die bei PA zunehmend auftretenden Resistenzen gegen die Therapie erschweren zudem eine nachhaltige Bekämpfung der Infektion. Die Mechanismen dieser Resistenzbildung genauer zu verstehen, hat sich die Arbeitsgrupppe um Prof. Dr. Martin Witzenrath und Dr. Gopinath Krishnamoorthy, an der Medizinischen Klinik mit Schwerpunkt Infektiologie und Pneumologie der Charité - Universitätsmedizin Berlin, mit dem aktuellen Forschungsprojektzur Aufgabe gemacht.
Abschlussbericht:
Der Abschlussbericht steht hier zum Download zur Verfügung
Abgeschlossenes Projekt
Aspergillus-spezifisches IL-17A als neuer Biomarker der akuten allergischen bronchopulmonalen Aspergillose (ABPA) bei Mukoviszidose
Antragsteller:
Dr. med. Carsten Schwarz, Klinikum Westbrandenburg
Laufzeit:
24 Monate
Kosten:
109.000 €
Hintergrund:
Die Lungenerkrankung der Mukoviszidose ist nicht nur durch bakterielle Infektionen geprägt, auch wenn diese meist im Vordergrund stehen. Die Lunge kann auch mit Pilzen besiedelt sein, deren Krankheitswert aber nicht immer klar ist. Der Fadenpilz Aspergillus fumigatus kommt bei ca. 25% der CF-Patienten vor und kann neben Lungenentzündungen auch Komplikationen wie die allergische bronchopulmonale Aspergillose (ABPA) verursachen. Aber nicht jede Besiedelung mit A. fumigatus bedeutet, dass der Patient auch eine ABPA hat, d. h. es stellt sich in der klinischen Praxis oft die Frage für den behandelnden Arzt, wann eine ABPA vorliegt. Die ABPA tritt bei bis zu 15 % der Patienten mit CF, aber zum Beispiel auch bei Patienten mit Asthma, auf. Insbesondere wenn eine ABPA spät diagnostiziert wird, können auch dauerhafte, irreversible Lungenschäden entstehen, die zum rascheren Fortschreiten der Lungenerkrankung führen.
Die Therapie der ABPA besteht zum einen aus antientzündlich wirksamen Corticosteroiden und zum anderen aus Substanzen, die gegen Aspergillus wirksam sind (Antimykotika). Um eine Behandlung vor dem Entstehen irreversibler Veränderungen einzuleiten, ist eine möglichst frühe Diagnosestellung essentiell. In frühen Krankheitsstadien sind die Symptome der ABPA jedoch noch unspezifisch (Verengung und vermehrte Schleimverlegung der Atemwege, Atemnot) und ähnlich denen, die durch bakterielle Krankheitserreger ausgelöst werden. Deshalb wird die ABPA noch häufig zu spät oder gar nicht diagnostiziert. Die Diagnosestellung der ABPA erfolgt anhand klinischer, radiologischer und laborchemischer Kriterien (entsprechend der 2003 von der CFF veröffentlichten internationalen Standards zur ABPA Diagnostik bei CF). Ausschlaggebend ist dabei eine starke Erhöhung allergietypischer und allergenspezifischer Antikörper (IgE). Anti-körper sind aber nach Antigen- oder Allergenkontakt für längere Zeit nachweisbar und spiegeln daher oft nicht die aktuelle immunologische Situation wider. Mit der kürzlich etablierten Methode der antigenreaktiven T-Zell-Anreicherung (ARTE) können pilzspezifische Immunreaktionen zeitgerechter charakterisiert werden und die ABPA Diagnostik bei CF möglicherweise verbessern. A. fumigatus löst in der Regel eine relativ geringe T-Zell Antwort aus, die bislang nicht detektierbar war – mit der ARTE Technologie werden die T-Zellen nun angereichert und sind nachweisbar – als spezifische Th1, Th2 und Th17-Zellen.
Ziele:
In einer Anfang 2019 publizierten Pilotstudie konnte die Arbeitsgruppe um Prof. Scheffold/Dr. Schwarz zeigen, dass A. fumigatus bei einer akuten und auch wiederkehrenden ABPA spezifische Th-17 Zellen anreichert. Unter einer ABPA Therapie verringerte sich diese Th-17 Immunantwort in dieser Untersuchung. Die Daten dieser Pilotstudie deuten damit darauf hin, die ARTE-Technologie für eine bessere ABPA-Diagnostik und Therapiekontrolle nutzen zu können. Die Th-17 spezifische Immunantwort bei ABPA soll demnach in dem beantragten Projekt jetzt an einer größeren Patientenkohorte mit CF und ABPA mithilfe der ARTE-Technik überprüft werden. Dabei sollen Grenzwerte ermittelt werden, um festlegen zu können, wann eine akute ABPA vorliegt. Dazu werden Patienten mit akuter pulmonaler Verschlechterung (Exazerbation) und ABPA mit einer Kontrollgruppe von Patienten mit Exazerbation ohne ABPA, deren Immunsystem aber bereits mit A. fumigatus in Kontakt gekommen ist (sensibilisiert hinsichtlich A. fumigatus), verglichen. Außerdem soll bei Patienten mit ABPA die Aspergillus fumigatus-spezifische Immunantwort in Form von IL-17A (ausgeschüttet von Th17-Zellen) untersucht werden, von der ange-nommen wird, dass sie während der gezielten ABPA-Therapie absinkt. Dadurch könnte IL-17A als Marker für den Therapieerfolg verwendet werden. Da IL-17A möglicherweise bei Patienten mit erhöhtem Risiko für eine ABPA andere Werte aufweist als bei Patienten, die keine ABPA entwickeln, soll IL-17A auch als prädiktiver Faktor bei Patienten vor dem Auftreten einer ABPA gemessen werden.
Finanzierung:
Der Landesverband Baden-Württemberg unterstützte die Studie mit insgesamt 109.000 €
Abschlussbericht:
Der Abschlussbericht steht hier zum Download zur Verfügung
Abgeschlossenes Projekt
Identifikation von extrazellulären Antigenen als Virulenzfaktoren von Pseudomonas aeruginosa unter anaeroben Bedingungen
Leitung der Studie:
Frau Dr. Sandra Schwarz, Institut für medizinische Mikrobiologie und Hygiene, Universität Tübingen
Beteiligte Wissenschaftler:
Annika Schmidt, Institut für medizinische Mikrobiologie und Hygiene, Universität Tübingen.
Professor Doktor Boris Macek, Proteomzentrum Tübingen
Laufzeit:
12 Monate
Ziel des Projekts:
Es sollen alternative Therapieansätze zur Behandlung der Pseudomonas-Infektion gefunden werden, die auf bisher nicht erforschten Proteinen basieren, die von Pseudomonas Aeruginosa unter anaeroben Bedingungen ausgeschüttet werden und als sogenannte „Virulenzfaktoren“ krankmachende Eigenschaften besitzen Bakterien sind extrem anpassungsfähig an Änderungen Ihre Lebensbedingungen. Entsprechend verändern sich auch die Pseudomonaden in der Lunge von CF Patienten, in dem sie sich zum Beispiel in weniger belüfteten Lungenarealen an die Lebensbedingungen ohne Sauerstoff (anaerob) anpassen. Im Laufe der Besiedelung und abhängig von den Lebensbedingungen entstehen bakterielle Nachkommen, die sich von dem ursprünglichen Bakterium, welches die Lunge zuerst besiedelt hat, unterscheiden. Die Forscher des Projekts sind nun besonders an den Pseudomonas Subpopulationen interessiert, die unter anaeroben Bedingungen in der Lunge von CF-Patienten leben. Sie vermuten, dass diese Bakterien andere krankmachende Faktoren in ihre Umgebung abgeben, als ihre unter Sauerstoffzufuhr lebenden Vorfahren. Bislang sind solche krankmachenden Exoproteine nicht systematisch für Pseudomonas Aeruginosa bei CF-Patienten untersucht worden. Das Ziel des Projektes ist, Pseudomonas Exoproteine zu finden, die unter anaeroben Bedingungen entstehen. Die Hypothese ist, dass diese anaeroben Exoproteine bisher noch nicht bekannte Faktoren sind, auf die zum einen das Immunsystem reagiert und die andererseits auch dafür sorgen, dass die Pseudomonaden Erkrankungssymptome verursachen. Es sollen besonders die Exoproteine gefunden werden, die in der frühen Phase der Infektion gebildet werden.
Finanzierung:
Der Landesverband Baden-Württemberg unterstützte die Studie mit insgesamt 20.000 €
Abschlussbericht:
Der Abschlussbericht steht hier zum Download zur Verfügung